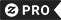Tapez / cliquez sur l'image pour voir plus de RealViewsTM
10,90 $CA
autocollants
Sticker Carré Élément individuel de l'hydrogène du tableau pério
Quantité :
Forme
Stickers carrés
+0,45 $CA
+0,45 $CA
+0,45 $CA
Taille
Type de papier
A propos de Autocollants
Vendu (e) par
À propos de ce design
Sticker Carré Élément individuel de l'hydrogène du tableau pério
Le tableau périodiс des éléments chimiques (aussi le tableau de Mendeleev, le tableau périodique des éléments ou juste le tableau périodique) est un tableau des éléments chimiques. Bien que des précurseurs de ce tableau existent, son invention est généralement créditée au chimiste russe Dmitri Mendeleev en 1869, qui avait l'intention de ce tableau d'illustrer les tendances récurrentes ("périodiques") des propriétés des éléments. La disposition du tableau a été affinée et étendue au fil du temps, à mesure que de nouveaux éléments ont été découverts et que de nouveaux modèles théoriques ont été élaborés pour expliquer le comportement chimique. Le tableau périodique est maintenant omniprésent dans la discipline universitaire de la chimie, fournissant un cadre extrêmement utile pour classifier, systématiser et comparer toutes les différentes formes de comportement chimique. Le tableau a trouvé une large application dans la chimie, la physique, la biologie et l'ingénierie, en particulier l'ingénierie chimique. Le tableau standard actuel contient 117 éléments en juillet 2009 En 1789, Antoine Lavoisier a publié une liste de 33 éléments chimiques. Bien que Lavoisier ait regroupé les éléments en gaz, métaux, non métaux et terres, les chimistes ont passé le siècle suivant à chercher un schéma de classification plus précis. En 1829, Johann Wolfgang Döbereiner a observé que beaucoup des éléments pouvaient être regroupés en triades (groupes de trois) en fonction de leurs propriétés chimiques. Le lithium, le sodium et le potassium, par exemple, ont été regroupés sous forme de métaux mous et réactifs. Döbereiner a également observé que, lorsqu'arrangé par le poids atomique, le deuxième membre de chaque triade était à peu près la moyenne des premier et troisième. C'est devenu la Loi des triades.[citation nécessaire] Le chimiste allemand Leopold Gmelin a travaillé avec ce système, et en 1843, il avait identifié dix triades, trois groupes de quatre et un groupe de cinq. Jean Baptiste Dumas publie en 1857 un ouvrage décrivant les relations entre divers groupes de métaux. Bien que divers chimistes aient pu identifier les relations entre de petits groupes d'éléments, ils n'avaient pas encore élaboré un schéma qui les englobe tous. Le chimiste allemand August Kekulé avait observé en 1858 que le carbone avait tendance à se lier à d'autres éléments dans un rapport de un à quatre. Le méthane, par exemple, a un atome de carbone et quatre atomes d'hydrogène. Ce concept est finalement devenu connu sous le nom de valence. En 1864, un autre chimiste allemand, Julius Lothar Meyer, publia un tableau des 49 éléments connus arrangés par valence. Le tableau a révélé que les éléments ayant des propriétés similaires partageaient souvent la même valeur. Le chimiste anglais John Newlands a publié une série d'articles en 1864 et 1865 qui décrivaient sa tentative de classification des éléments : Une fois listé par ordre d'augmentation du poids atomique, des propriétés physiques et chimiques similaires se sont répétées à intervalles de huit, qu'il comparait aux octaves de la musique. Cette loi des octaves, cependant, a été ridiculisée par ses contemporains[8]. Portrait de Dmitri MendeleevDmitri Ivanovich Mendeleev, professeur de chimie russe, et Julius Lothar Meyer ont publié leurs tableaux périodiques respectivement en 1869 et 1870. Ils ont construit leurs tables de la même manière : en listant les éléments dans une rangée ou une colonne par ordre de poids atomique et en commençant une nouvelle rangée ou une nouvelle colonne lorsque les caractéristiques des éléments ont commencé à se répéter. Le succès de la table de Mendeleev est venu de deux décisions qu'il a prises : la première était de laisser des lacunes dans la table quand il semblait que l'élément correspondant n'avait pas encore été découvert. Mendeleev n'était pas le premier chimiste à le faire, mais il a fait un pas de plus en utilisant les tendances de son tableau périodique pour prédire les propriétés de ces éléments manquants, comme le gallium et le germanium. La deuxième décision a été d'ignorer occasionnellement l'ordre suggéré par les poids atomiques et de changer les éléments adjacents, comme le cobalt et le nickel, pour mieux les classer dans les familles chimiques. Avec le développement de théories de la structure atomique, il est devenu évident que Mendeleev avait par inadvertance énuméré les éléments dans l'ordre de l'augmentation du nombre atomique. Avec le développement de théories mécaniques quantiques modernes de configurations d'électrons dans les atomes, il est devenu évident que chaque ligne (ou période) de la table correspondait au remplissage d'une coquille quantique d'électrons. Dans la table originale de Mendeleev, chaque période était de la même longueur. Cependant, comme les atomes plus gros ont plus de sous-coques électroniques, les tables modernes ont progressivement des périodes plus longues plus loin dans la table. Dans les années qui ont suivi la publication de son tableau périodique par Mendeleev, les fossés qu'il a laissés ont été comblés quand les chimistes ont découvert plus d'éléments chimiques. Le dernier élément naturel à découvrir était Francium (appelé eka-caesium par Mendeleev) en 1939. Le tableau périodique a également augmenté avec l'ajout d'éléments synthétiques et transuraniques. Le premier élément transuranique à être découvert était le neptunium, qui a été formé par bombardement d'uranium avec des neutrons dans un cyclotron en 1939 "Tableau périodique des éléments" Tableau périodique des éléments Dmitri Mendeleev Antoine Lavoisier Chimie Chimie Physique Laboratoire Expérience Expérience Poster Août Kekulé Biochimie biologique biologique Biologiste Composés Moléculaires Mole Moléculaire Avogadro Formule Symbole "Symbole chimique" Atom Atome "Poids atomique" Proton Neutron Electron Deuterium Tritium Isotope Isomer Molarité Radioactif Noyau Orbital Spin Quantum Ligne Période Actinium Aluminium Américide Argent Argent Arsenic Astatine Barium Berkelium Bismuth Bohrium Boron Bromine Cadmium Calcium Californie Carbone Cesium Chlorine Chlorine Cobalt Cuivre Curium Darmstadtium Dubnium Dysprosium Einsteinium Erbium Europium Fermium Fluorine Francium Gadolinium Gallium Germanium Or Hafnium Hameum Hameçon Hameçon Holmium Iode Iridium Fer Krypton Lawrencium Plomb Lithium Lutetium Magnéum Manganèse Mendelevium Mercury Molybdène Neodymium Neon Neptunium Niobium Nitrogen Nobelium Osmium Oxygène Palladium Phosphorus Platine Plutonium Polonium Poassium Praseotacium Protéum Radium Radon Rhénium Rhodium Rubidium Ruthénium Rutherfordium Samarium Scandium Seaborgium Sélénium Silicon Sodium Strontium Soufre Tantalum Tellurium Terbium Thallium Thulium Tin Titane Tungstène Ununbium Ununnilium Ununumium Uranium Vanadium Xenon Ytenon bium Yttrium Zinc Zirconium
Traduction automatique
Avis des clients
5.0 sur 5 étoiles40 Nombres de Commentaires
40 Commentaires
Avis sur des produits similaires
5 sur 5 étoiles
Par K.3 novembre 2025 • Achat sécurisé
Tres satisfaite, je recommande.
5 sur 5 étoiles
Par Papa!! q.14 février 2023 • Achat sécurisé
Programme d'évaluation de Zazzle
L'autocollant colle très bien. Beau produit. L'impression est superbe. Merci beaucoup.
5 sur 5 étoiles
Par K.3 novembre 2025 • Achat sécurisé
Tres satisfaite de mon achat.
Tags
Autres infos
Identifiant du produit : 217001405409632582
Fabriqué le 2013-01-14 19:13
Évalué G
Articles vus récemment